Die Jagd nach neuen Batterien ist in vollem Gange. Dabei verfolgen Hersteller und Forscher mehrere Ziele. Zum einen sollen die Akkus mehr Energie aufnehmen können und dabei auch noch leichter werden. Zum anderen spielt die Sicherheit eine sehr große Rolle. Ein drittes Ziel ist es, die Herstellungskosten und damit die Preise für die Akkus weiter zu drücken. Letzteres kann wiederum mittels einer hochskalierten Produktion erreicht werden. Das ist der Ansatz, den vor allem Hersteller verfolgen, indem sie ihre Produktionskapazitäten nach oben schrauben und damit die Stückkosten senken.
Forscher hingegen wollen vor allem an neuen Materialien ansetzen. Die teuren Elemente zu ersetzen, ist aber nicht einfach. In der Regel werden derzeit neben Lithium-Eisen-Phosphat vor allem Lithium-Kobalt-Oxid als Kathodenmaterial eingesetzt. Die Anode besteht aus Graphit. Das Kathodenmaterial zu ersetzen ist schwierig. Schließlich muss das Lithium in der Batterie irgendwo herkommen. Als Ersatzmaterial für das Kobalt bieten sich aber andere Elemente an, wie zum Beispiel Schwefel.
Gefährliche Türme aus Lithium
Um dieses Dilemma zu lösen, wird schon seit Jahren an einer Anode geforscht, die aus reinem Lithium besteht. Denn das reine Metall kann seinerseits mehr Ionen aufnehmen, was die Speicherdichte drastisch erhöht. Zudem ist es leichter als Graphit. Es wiegt weniger als ein Achtel des bisher eingesetzten Graphits. Auch Silizium, das als Alternative zum Graphit eingesetzt wird, wiegt acht Mal mehr als Lithium. Doch das Problem bisher ist, dass sich bei beim Ladevorgang die Lithiumionen nur unregelmäßig anlagern. Das führt dazu, dass sich sogenannte Dendriten bilden. Das ist – einfach gesagt – ein langer Stapel von Lithiumatomen, die immer weiter anwachsen. Wenn sie lang genug sind, durchstoßen sie den Separator und schließen den Akku kurz. Der geht thermisch durch und fängt an zu brennen.
Anode in Salzlösung eintauchen
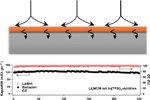
Deshalb suchen die Forscher schon seit langem nach einer Möglichkeit, das Wachstum der Dendriten zu unterbinden. Die Ideen reichen von einer Nanobeschichtung bis hin zu einem Elektrolyten aus Glas. Beide Varianten funktionieren, sind aber kaum für die Massenfertigung geeignet. Wissenschaftler vom Rensselaer Polytechnic Institute in Troy, Michigan und von der Cornell University Ithaca, New York, haben erfolgreich eine dünnen Indiumschicht auf das Lithium aufgebracht. Um das zu bewerkstelligen, reiche es aus, die Lithiumanode in eine wässrige Lösung mit einem Indiumsalz zu tauchen, erklären die Forscher. Dabei scheidet sich ein Teil des Metalls an der Lithiumoberfläche ab. Zudem ist die Indiumschicht selbstheilend, wenn dem Elektrolyt geringe Mengen des Indiumsalzes beigemengt werden, haben die amerikanischen Wissenschaftler beobachtet. Zudem haben sie festgestellt, dass das die Indiumschicht das Wachstum der Dendriten verhindert.
Ionen wandern durch die Indiumschicht
Die Oberfläche bleibt dabei für die Lithiumionen durchlässig. Diese treffen natürlich zunächst auf die Indiumschicht. Doch sie sind daran nur sehr locker gebunden. Sie bilden zusammen mit dem Indium zunächst eine Legierung, wodurch sie sich sehr schnell an der Schicht entlang bewegen und diese durchqueren können. Der Vorteil ist, wenn die Lösung tatsächlich auch auf industriellem Niveau funktioniert, kann das Lithium aus der Kathode komplett verschwinden. Damit wäre der Weg für leichtere Akkus mit höherer Energiedichte frei.
Die Amerikaner haben auch schon fertige Batteriezellen mit ihrem neuen Konzept hergestellt, es bisher aber nur auf 250 Vollzyklen geschafft. Dabei blieben die Zellen stabil und hatten am Ende immer noch 90 Prozent ihrer ursprünglichen Kapazität. Ob das der Durchbruch für die Lithium-Anode ist, wird sich zeigen. Zumindest muss die Zyklenanzahl bei gleichbleibender Kapazität erhöht werden, um diese Batterien auch massenhaft einsetzen zu können. Die amerikanischen Forscher haben ihre Ergebnisse jetzt in der Zeitschrift „Angewandte Chemie“ veröffentlicht. (Sven Ullrich)